La tossicità dei cerotti transdermici viene monitorata attraverso una combinazione di studi preclinici sull'irritazione cutanea, modelli predittivi e sorveglianza post-vendita.I metodi primari includono il test Primary Irritation Index (PII) per valutare le reazioni cutanee localizzate come eritema ed edema, insieme a modelli computazionali che analizzano le interazioni farmaco-pelle.I protocolli di smaltimento adeguati sono fondamentali per prevenire i rischi di esposizione secondaria.Questi approcci stratificati garantiscono la sicurezza dallo sviluppo all'uso reale.
Punti chiave spiegati:
-
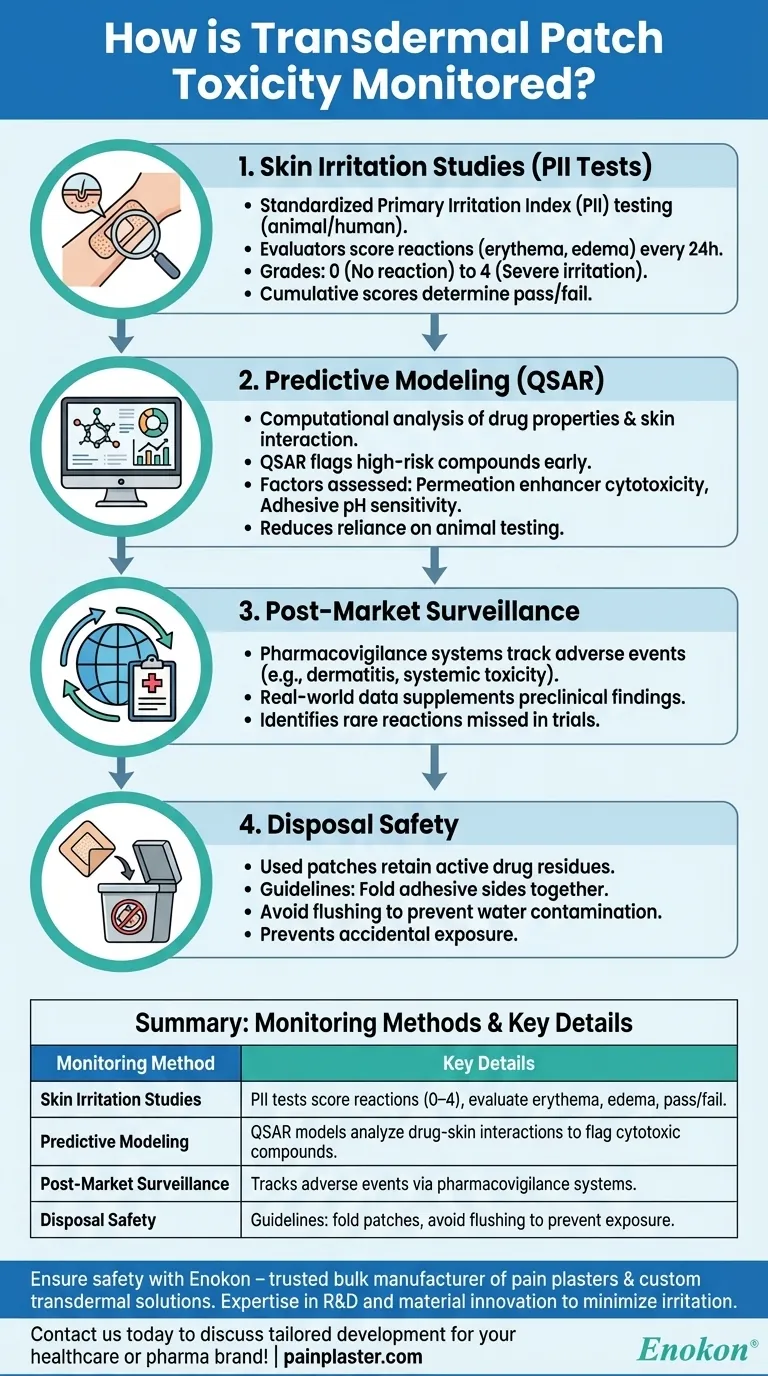
Studi di irritazione cutanea (test PII)
- Il cerotto transdermico è sottoposto a test standardizzati dell'Indice di Irritazione Primaria (PII), in cui i cerotti vengono applicati sulla pelle animale o umana in condizioni controllate.
-
I valutatori assegnano un punteggio alle reazioni (arrossamento, gonfiore) a intervalli di 24 ore, con voti da 0 (nessuna reazione) a 4 (grave irritazione):
- da 0 (nessuna reazione) a 4 (grave irritazione).
- I punteggi cumulativi determinano le soglie di accettazione/rifiuto per ulteriori sviluppi.
-
Modellazione predittiva
- Gli strumenti computazionali analizzano le proprietà dei farmaci (ad esempio, solubilità, peso molecolare) e la loro interazione con gli strati cutanei.
- Modelli come il QSAR (Quantitative Structure-Activity Relationship) individuano precocemente i composti ad alto rischio, riducendo il ricorso alla sperimentazione animale.
-
Fattori valutati:
- Citotossicità dei potenziatori della permeazione chimica.
- Sensibilità al pH degli strati adesivi.
-
Sorveglianza post-commercializzazione
- I sistemi di farmacovigilanza tengono traccia degli eventi avversi (per esempio, dermatiti da contatto, tossicità sistemica) segnalati dagli operatori sanitari o dai pazienti.
- I dati del mondo reale integrano i risultati preclinici, identificando reazioni rare che non sono state prese in considerazione negli studi.
-
Sicurezza dello smaltimento
- I cerotti usati conservano residui di farmaci attivi; lo smaltimento improprio rischia l'esposizione accidentale (ad esempio, bambini/animali domestici).
-
Le linee guida includono:
- Ripiegare i lati adesivi prima dello smaltimento.
- Evitare il lavaggio per prevenire la contaminazione dell'acqua.
-
Tecnologie emergenti
- Gli array di microaghi e i materiali biodegradabili mirano a ridurre i rischi di irritazione e a migliorare la precisione della somministrazione dei farmaci.
Integrando queste strategie, i produttori bilanciano l'efficacia con la sicurezza del paziente, assicurando che i cerotti soddisfino gli standard normativi e riducendo al minimo i danni.Avete considerato come le innovazioni dei materiali potrebbero ridurre ulteriormente l'irritazione nei progetti futuri?
Tabella riassuntiva:
| Metodo di monitoraggio | Dettagli chiave |
|---|---|
| Studi sull'irritazione cutanea | I test PII assegnano un punteggio alle reazioni (0-4) per valutare l'eritema, l'edema e le soglie pass/fail. |
| Modellazione predittiva | I modelli QSAR analizzano le interazioni farmaco-pelle per individuare precocemente i composti citotossici. |
| Sorveglianza post-vendita | Traccia gli eventi avversi (ad esempio, dermatiti) attraverso i sistemi di farmacovigilanza. |
| Sicurezza nello smaltimento | Le linee guida prevedono di piegare i cerotti e di evitare di sciacquarli per evitare l'esposizione. |
Assicuratevi che i vostri cerotti transdermici soddisfino gli standard di sicurezza con Enokon -il vostro produttore di fiducia di cerotti antidolorifici affidabili e di soluzioni transdermiche personalizzate.La nostra esperienza nella ricerca e sviluppo e nell'innovazione dei materiali ci consente di ridurre al minimo i rischi di irritazione e di massimizzare l'efficacia. Contattateci oggi stesso per discutere dello sviluppo su misura per il vostro marchio sanitario o farmaceutico!
Guida Visiva
Prodotti correlati
- Cerotti antidolorifici al calore dell'infrarosso lontano Cerotti transdermici
- Cerotti riscaldanti antidolorifici per i crampi mestruali
- Toppa protettiva per gli occhi a base di erbe Toppa per gli occhi
- Cerotto antidolorifico di medicina al mentolo Icy Hot
- Cerotto antidolorifico in gel al mentolo
Domande frequenti
- Come funziona la capsaicina nel cerotto termico medicato?La scienza alla base del dolore
- Si possono usare i cerotti di calore per le lesioni fresche?Perché la terapia del freddo funziona meglio
- Come funziona il cerotto per la schiena Deep Heat Pain Relief?Sollievo dal dolore senza farmaci con il calore terapeutico
- I cerotti termici sono sicuri per tutte le parti del corpo?Linee guida fondamentali per un uso sicuro
- Quali sono gli effetti collaterali comuni dell'uso del cerotto termico medicato?Comprendere i rischi e l'uso sicuro












