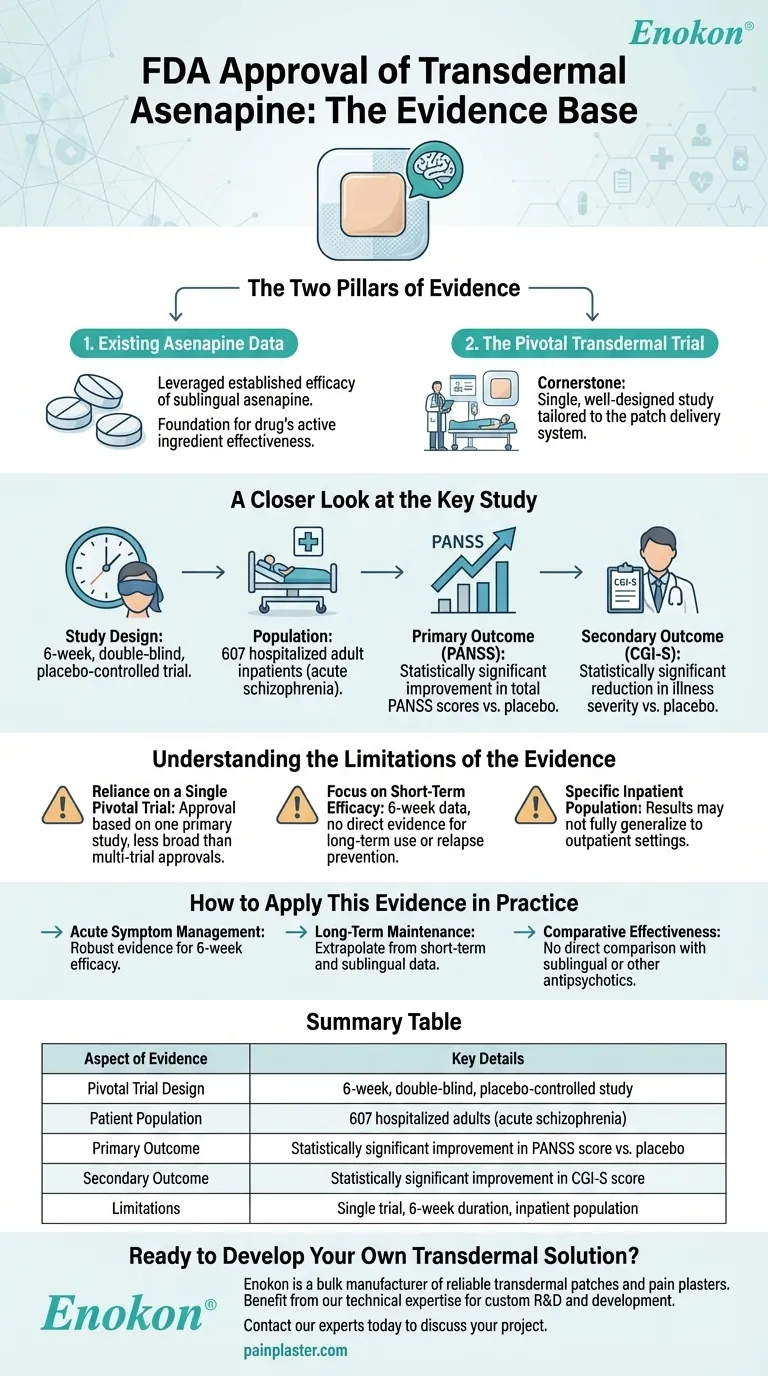
L'approvazione da parte della FDA del Asenapina Patch (asenapina transdermica) è stato supportato da una combinazione di dati di efficacia precedenti provenienti da studi sull'asenapina sublinguale e da uno studio cardine di 6 settimane, in doppio cieco e controllato con placebo, che ha coinvolto 607 pazienti adulti ricoverati con schizofrenia.La formulazione transdermica ha dimostrato miglioramenti statisticamente significativi in entrambi gli endpoint primari (punteggi PANSS) e secondari (valutazioni CGI-S) rispetto al placebo, confermando il suo beneficio terapeutico.Queste prove hanno stabilito collettivamente la sicurezza, l'efficacia e la rilevanza clinica del cerotto per il trattamento della schizofrenia.
Punti chiave spiegati:
-
Dati precedenti sull'efficacia dell'asenapina sublinguale
- I precedenti studi di valutazione dell'asenapina sublinguale hanno fornito prove fondamentali del meccanismo d'azione del farmaco e del suo potenziale terapeutico nella schizofrenia.
- Questi studi hanno probabilmente informato il dosaggio, i profili di sicurezza e i risultati attesi per la formulazione transdermica, semplificando il percorso di approvazione.
-
Studio pivotale in doppio cieco di 6 settimane
- Disegno dello studio:Uno studio rigoroso, controllato con placebo, con 607 partecipanti, ha garantito una solida potenza statistica e minimizzato i bias.
- Popolazione:Focalizzato su pazienti adulti ricoverati con schizofrenia, riflette il target demografico per l'uso clinico.
- Durata:L'arco temporale di 6 settimane ha bilanciato la valutazione dei sintomi acuti con l'applicabilità clinica pratica.
-
Endpoint primario:Punteggi PANSS
- La scala PANSS (Positive and Negative Syndrome Scale) è un gold standard per valutare la gravità dei sintomi della schizofrenia.
- Miglioramenti statisticamente significativi nei punteggi PANSS hanno confermato l'efficacia del cerotto nel ridurre i sintomi positivi (ad esempio, allucinazioni) e negativi (ad esempio, ritiro sociale).
-
Endpoint secondario:Valutazioni CGI-S
- La scala Clinical Global Impression-Severity (CGI-S) ha fornito una convalida del miglioramento dei sintomi riferita dal medico.
- La significatività in questo caso ha rafforzato i benefici clinici osservabili e specifici del paziente.
-
Sicurezza e tollerabilità
- Sebbene non sia esplicitamente descritto nei riferimenti, l'approvazione della FDA implica che la formulazione transdermica ha soddisfatto i parametri di sicurezza, probabilmente sfruttando i dati relativi alla somministrazione sublinguale e le segnalazioni di eventi avversi dei nuovi studi.
- La somministrazione transdermica può offrire vantaggi come la riduzione degli effetti collaterali sistemici (ad esempio, rispetto alle vie orali o iniettabili).
-
Razionale normativo
- La decisione della FDA si è basata su un'efficacia riproducibile (PANSS/CGI-S) e su un chiaro profilo rischio-beneficio, supportato da dati di studi controllati.
- La praticità del cerotto e i vantaggi in termini di aderenza (ad esempio, il rilascio prolungato, la via non orale) possono aver ulteriormente giustificato l'approvazione per una popolazione spesso in difficoltà con la compliance ai farmaci.
Per gli acquirenti di prodotti sanitari, queste evidenze sottolineano l'importanza di Asenapina Patch come opzione valida e comprovata per la gestione della schizofrenia, con potenziali vantaggi in termini di somministrazione e tollerabilità.Il suo formato transdermico sarebbe in linea con le esigenze dei vostri pazienti o con i protocolli istituzionali?
Tabella riassuntiva:
| Prove chiave per l'approvazione della FDA | Dettagli |
|---|---|
| Dati precedenti sull'asenapina sublinguale | Meccanismo d'azione e profilo di sicurezza consolidati |
| Studio pivotale di 6 settimane | 607 pazienti adulti ricoverati con schizofrenia, in doppio cieco, controllato con placebo |
| Endpoint primario (punteggi PANSS) | Riduzione statisticamente significativa dei sintomi |
| Endpoint secondario (valutazioni CGI-S) | Miglioramento della gravità confermato dal medico |
| Sicurezza e tollerabilità | Soddisfa i parametri della FDA, potenziali vantaggi in termini di aderenza |
| Motivazione normativa | Efficacia riproducibile e chiaro profilo rischio-beneficio |
Siete interessati a integrare l'asenapina transdermica nei vostri protocolli di trattamento?
Come produttore di fiducia di cerotti transdermici e cerotti per il dolore, Enokon offre soluzioni affidabili e clinicamente validate per distributori di prodotti sanitari e marchi farmaceutici.La nostra esperienza nella R&S personalizzata garantisce formulazioni su misura per le esigenze dei pazienti.
Contattateci oggi stesso per discutere delle opportunità di partnership o per richiedere campioni di prodotto.
Guida Visiva
Prodotti correlati
- Cerotto per la tosse e il dolore da asma per adulti e bambini
- Cerotto antidolorifico in gel al mentolo
- Cerotto antidolorifico di medicina al mentolo Icy Hot
- Cerotti per il sollievo dal calore profondo a infrarossi lontani Cerotti medicati per il sollievo dal dolore
- Toppa protettiva per gli occhi a base di erbe Toppa per gli occhi
Domande frequenti
- Come funziona la capsaicina nel Reliever Patch?Una soluzione senza farmaci per un sollievo mirato dal dolore
- I cerotti antidolorifici sono sicuri per la pelle sensibile?Come usarli in modo sicuro
- Come funziona la tecnologia a infrarossi lontani del cerotto antitosse?Scoprite un sollievo che penetra in profondità
- Le donne in gravidanza possono usare i cerotti antidolorifici?Sicurezza e alternative spiegate
- Come devono essere gestite le dosi mancate di Reliever Patch?Linee guida per un uso sicuro















