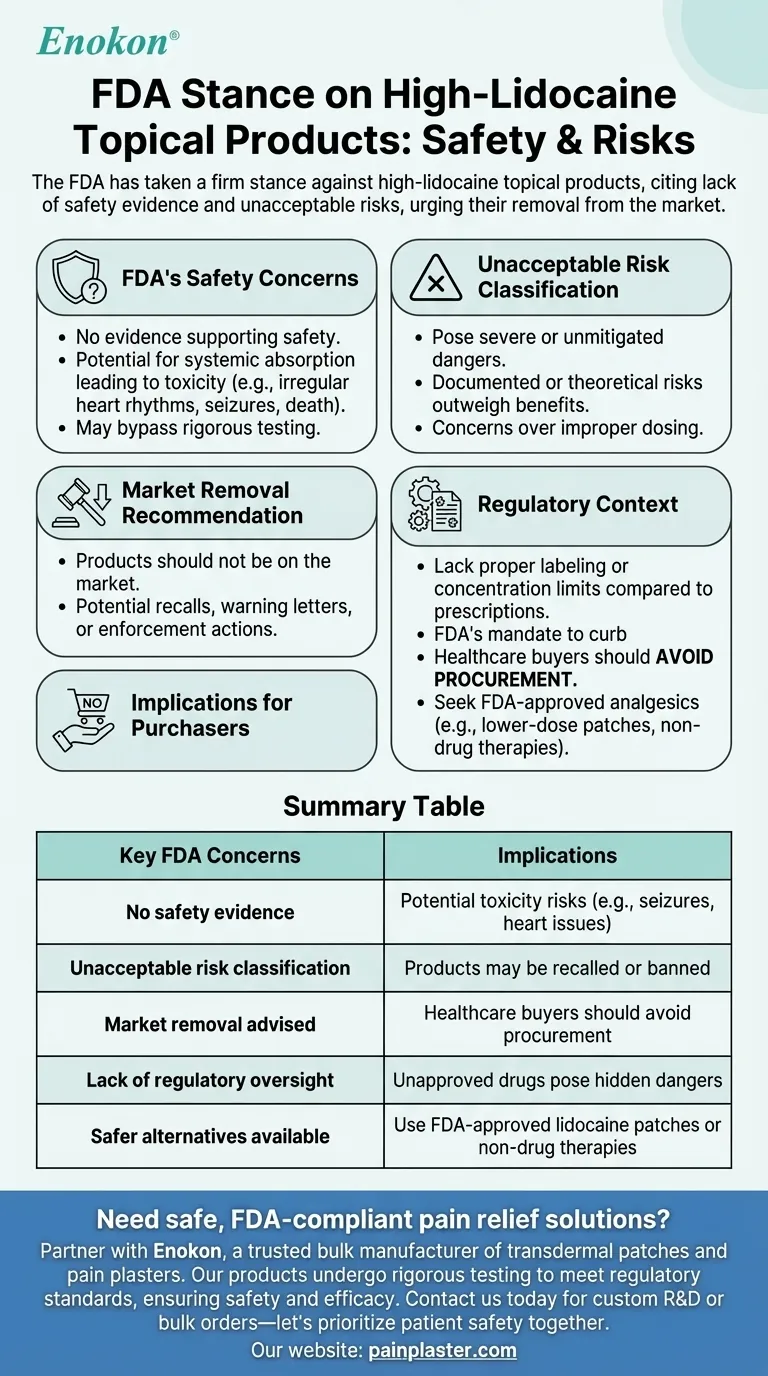
La FDA ha preso una posizione ferma contro i prodotti topici ad alto contenuto di lidocaina, citando la mancanza di prove sulla loro sicurezza e ritenendo che presentino rischi inaccettabili per i consumatori.L'agenzia afferma esplicitamente che questi prodotti non dovrebbero essere disponibili sul mercato a causa dei potenziali rischi per la salute.Questa posizione riflette le preoccupazioni per le indicazioni di sicurezza non verificate e il potenziale di uso improprio o di effetti avversi, sottolineando la necessità di un controllo normativo più rigoroso per proteggere la salute pubblica.

Punti chiave spiegati:
-
Le preoccupazioni della FDA in materia di sicurezza
- La FDA non ha nessuna prova a sostegno della sicurezza dei prodotti topici ad alto contenuto di lidocaina.
- Questa mancanza di dati solleva un allarme sui rischi potenziali, come l'assorbimento sistemico che porta alla tossicità (ad esempio, ritmi cardiaci irregolari, convulsioni o persino la morte in casi estremi).
- La posizione dell'agenzia implica che questi prodotti possono eludere i rigorosi test richiesti per i farmaci approvati, aumentando l'incertezza sui loro effetti.
-
Classificazione del rischio inaccettabile
- L'FDA classifica questi prodotti come rischi inaccettabili è una designazione rara, riservata a prodotti con pericoli gravi o non eliminabili.
- Ciò suggerisce che gli eventi avversi documentati o i rischi teorici (per esempio, un dosaggio improprio dovuto alla mancanza di standardizzazione) superano i benefici percepiti.
-
Raccomandazione di rimozione dal mercato
- L'affermazione che questi prodotti non dovrebbero essere sul mercato sottolinea l'approccio proattivo della FDA alla tutela dei consumatori.
- Questo può portare a richiami, lettere di avvertimento ai produttori o azioni esecutive nei confronti dei distributori.
-
Contesto normativo
- A differenza della lidocaina da prescrizione (che prevede controlli sul dosaggio e una supervisione clinica), i prodotti ad alto contenuto di lidocaina da banco possono non avere un'etichettatura adeguata o limiti di concentrazione.
- La posizione della FDA è in linea con il suo mandato di porre un freno ai farmaci non approvati mascherati da rimedi topici.
-
Implicazioni per gli acquirenti
- Gli acquirenti del settore sanitario dovrebbero evitare di acquistare di questi prodotti fino a quando ulteriori prove o riformulazioni non risolveranno le preoccupazioni dell'FDA.
- Analgesici alternativi approvati dalla FDA (ad esempio, cerotti di lidocaina a basso dosaggio o terapie non farmacologiche) possono essere sostituti più sicuri.
L'avvertimento della FDA serve a ricordare i pericoli nascosti nei prodotti OTC apparentemente benigni, esortando sia i consumatori che i professionisti a dare la priorità a dati verificati sulla sicurezza piuttosto che ad affermazioni aneddotiche.
Tabella riassuntiva:
| Principali preoccupazioni della FDA | Implicazioni |
|---|---|
| Nessuna prova di sicurezza | Potenziali rischi di tossicità (ad es. convulsioni, problemi cardiaci) |
| Classificazione del rischio inaccettabile | I prodotti possono essere richiamati o vietati |
| Si consiglia il ritiro dal mercato | Gli acquirenti del settore sanitario dovrebbero evitare gli appalti |
| Mancanza di controllo normativo | I farmaci non approvati comportano pericoli nascosti |
| Sono disponibili alternative più sicure | Utilizzare cerotti di lidocaina approvati dalla FDA o terapie non farmacologiche |
Avete bisogno di soluzioni sicure e conformi alla FDA per alleviare il dolore? Collaborate con Enokon è un affidabile produttore all'ingrosso di cerotti transdermici e cerotti antidolorifici per distributori e marchi del settore sanitario.I nostri prodotti sono sottoposti a test rigorosi per soddisfare gli standard normativi, garantendo sicurezza ed efficacia. Contattateci oggi stesso per ricerche personalizzate o ordini in blocco: insieme diamo la priorità alla sicurezza del paziente.
Guida Visiva
Prodotti correlati
- Cerotto antidolorifico in idrogel di lidocaina per alleviare il dolore
- Cerotti antidolorifici medicati alla capsaicina e al peperoncino
- Cerotti per il sollievo dal calore profondo a infrarossi lontani Cerotti medicati per il sollievo dal dolore
- Toppe di raffreddamento mediche del gel per le toppe di raffreddamento della febbre
- Cerotto antidolorifico di medicina al mentolo Icy Hot
Domande frequenti
- Quali sono i potenziali effetti collaterali dei cerotti alla lidocaina?Comprendere i rischi per un sollievo sicuro dal dolore
- Quali sono le istruzioni per l'applicazione dei cerotti di lidocaina?Guida al trattamento del dolore sicuro ed efficace
- Quali sono le indicazioni principali sulla sicurezza dei cerotti alla lidocaina?Linee guida essenziali per un uso sicuro
- Quali sono le alternative ai cerotti di lidocaina per il dolore lombare?Esplora le opzioni efficaci per alleviare il dolore
- Quali sono le comuni reazioni cutanee localizzate causate dai cerotti di lidocaina?Gestione di irritazioni e allergie
















