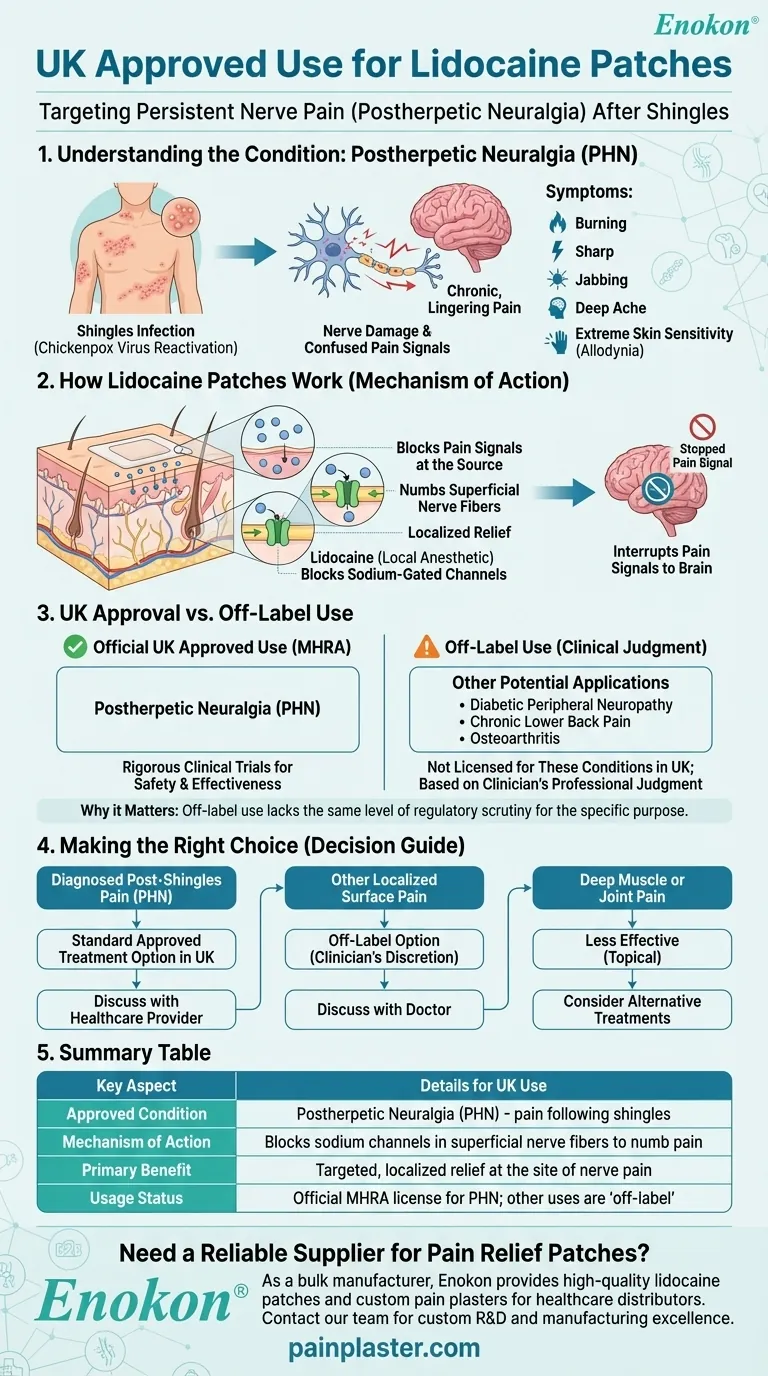
Nel Regno Unito, cerotti di lidocaina sono approvati specificamente per il trattamento della nevralgia post-erpetica (PHN), una condizione di dolore nervoso persistente che può verificarsi dopo un'infezione da herpes zoster.Sebbene la ricerca suggerisca potenziali usi off-label per altre condizioni di dolore, l'approvazione del Regno Unito è strettamente incentrata sulla gestione della PHN.Questo differisce leggermente dalle approvazioni più ampie della FDA, riflettendo le distinzioni normative regionali negli approcci al trattamento del dolore.

Punti chiave spiegati:
-
Indicazione primaria approvata nel Regno Unito
- I cerotti a base di lidocaina sono approvati esclusivamente per la nevralgia posterpetica (PHN) nel Regno Unito.
- La PHN è una sindrome dolorosa neuropatica conseguente all'herpes zoster (infezione da virus), caratterizzata da dolore persistente nelle aree cutanee precedentemente colpite.
-
Meccanismo d'azione per la PHN
- I cerotti forniscono lidocaina localizzata (concentrazione del 5%) per bloccare i segnali nervosi anomali nei nervi periferici danneggiati.
- L'applicazione topica minimizza l'assorbimento sistemico, riducendo gli effetti collaterali rispetto agli analgesici orali.
-
Contesto normativo
- L'approvazione del Regno Unito è in linea con il quadro normativo dell'Agenzia Europea dei Medicinali (EMA), che in genere richiede solide prove cliniche per indicazioni specifiche.
- A differenza della FDA, gli enti regolatori del Regno Unito/UE non hanno esteso l'approvazione ad altre condizioni di dolore neuropatico (ad esempio, la neuropatia diabetica), nonostante le ricerche emergenti.
-
Considerazioni cliniche
- I cerotti vengono applicati direttamente sulla pelle intatta delle aree dolorose per un massimo di 12 ore al giorno.
- Le controindicazioni includono l'ipersensibilità alla lidocaina o ai componenti del cerotto.
-
Potenziale di uso fuori etichetta
- Sebbene non sia stato approvato nel Regno Unito, alcuni studi hanno evidenziato l'efficacia nell'osteoartrite, nel mal di schiena cronico e nel dolore post-chirurgico.
- I prescrittori possono prendere in considerazione l'uso off-label in base alle esigenze dei singoli pazienti e alla valutazione dei rischi e dei benefici.
-
Implicazioni per gli acquisti
- L'approvvigionamento sanitario deve privilegiare le formulazioni verificate e approvate dal Regno Unito per il trattamento della PHN.
- Per la ricerca o le applicazioni estese, i protocolli istituzionali possono richiedere ulteriori giustificazioni.
L'approvazione mirata del Regno Unito riflette un approccio cauto alla gestione del dolore neuropatico, sottolineando l'uso basato sull'evidenza per la PHN e riconoscendo al contempo un potenziale terapeutico più ampio grazie alla ricerca in corso.
Tabella riassuntiva:
| Aspetto chiave | Dettagli |
|---|---|
| Condizione approvata | Solo nevralgia post-herpetica (PHN) |
| Meccanismo d'azione | Erogazione localizzata di lidocaina al 5% per bloccare i segnali nervosi anomali |
| Linee guida per l'applicazione | Applicare sulla pelle intatta per ≤12 ore/giorno; evitare le aree ipersensibili. |
| Ambito normativo | Approvazione allineata all'EMA (nessuna estensione nel Regno Unito per altre condizioni di dolore neuropatico) |
| Potenziale Off-Label | Osteoartrite, mal di schiena cronico (richiede la discrezione del prescrittore) |
Avete bisogno di cerotti di lidocaina affidabili per il trattamento della PHN? Come produttore di fiducia di soluzioni transdermiche per il trattamento del dolore, Enokon offre:
- Formulazioni conformi al Regno Unito per la gestione della nevralgia post erpetica
- Supporto R&D personalizzato per distributori e marchi del settore sanitario
- Produzione certificata GMP che garantisce una qualità e un'efficacia costanti
Contattate il nostro team per discutere delle esigenze di approvvigionamento o di sviluppo oggi stesso!
Guida Visiva
Prodotti correlati
- Cerotto antidolorifico in idrogel di lidocaina per alleviare il dolore
- Cerotti antidolorifici medicati alla capsaicina e al peperoncino
- Cerotti per il sollievo dal calore profondo a infrarossi lontani Cerotti medicati per il sollievo dal dolore
- Cerotto per la tosse e il dolore da asma per adulti e bambini
- Cerotti riscaldanti antidolorifici per i crampi mestruali
Domande frequenti
- Quali sono gli effetti collaterali comuni della lidocaina topica?Rischi e consigli di sicurezza
- Che tipo di disegno di studio è stato utilizzato per valutare il cerotto di lidocaina 5% per la lombalgia cronica?
- Qual è lo stato normativo dei cerotti Lidoderm per la nevralgia post-erpetica?Sollievo approvato dalla FDA per la PHN
- Ci sono note aggiuntive sulla lidocaina 5 per cento cerotto topico?Principali informazioni sulla sicurezza e sull'uso
- Quali precauzioni speciali si applicano all'uso dei cerotti di lidocaina?Consigli di sicurezza essenziali per un efficace sollievo dal dolore
- Come funziona un cerotto alla lidocaina per alleviare il dolore?Spiegazioni sul dolore mirato
- Quali condizioni devono essere segnalate prima di utilizzare un cerotto cutaneo alla lidocaina?Garantire un sollievo sicuro dal dolore
- Qual è l'uso principale della lidocaina topica?Sollievo dal dolore mirato per la pelle e le ferite minori
















