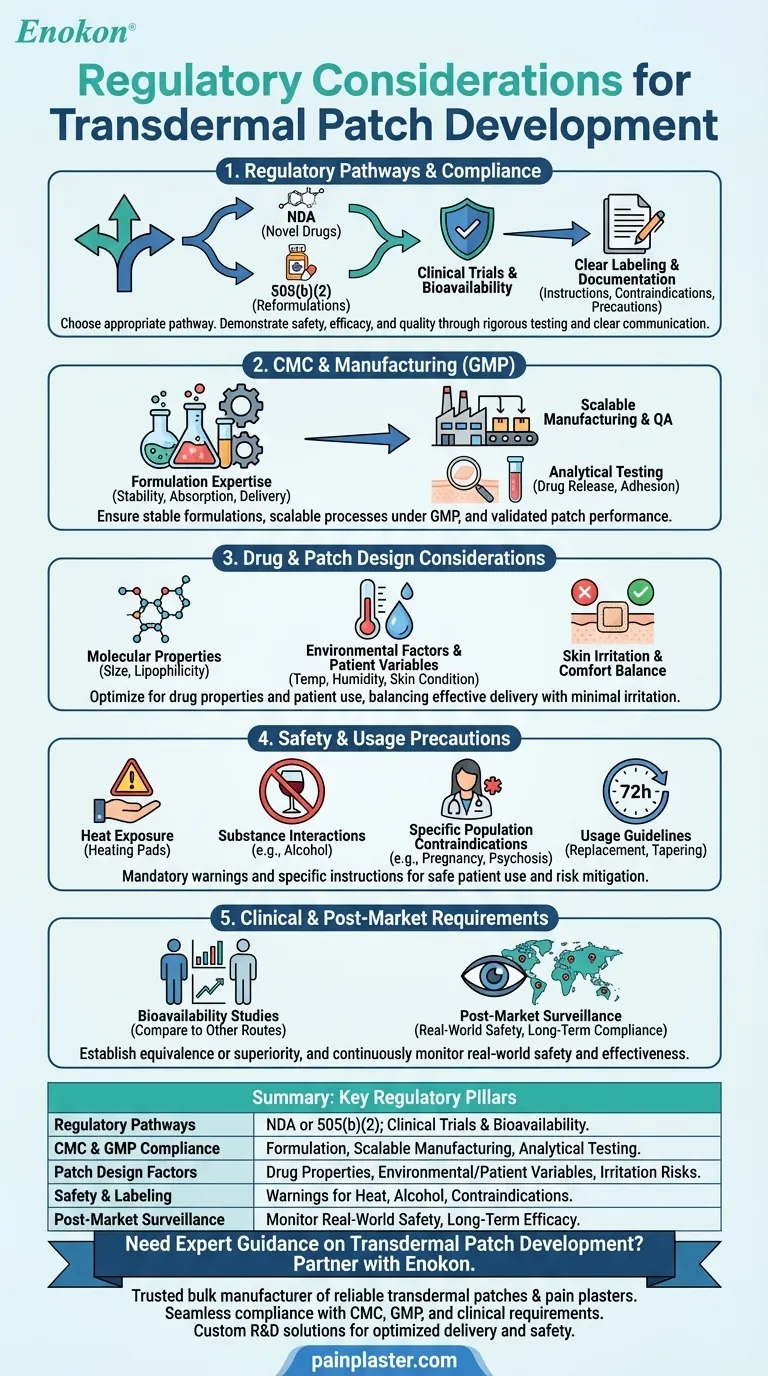
Lo sviluppo di cerotti transdermici comporta la necessità di navigare in un complesso panorama normativo per garantire sicurezza, efficacia e qualità.Le considerazioni principali includono la conformità ai requisiti di chimica, produzione e controllo (CMC), l'aderenza alle buone pratiche di fabbricazione (GMP) e test clinici approfonditi per la biodisponibilità e la sicurezza.Il design del patch deve tenere conto delle proprietà del farmaco (ad esempio, dimensioni molecolari, polarità) e dei fattori ambientali, mentre l'etichettatura e la documentazione devono soddisfare standard rigorosi.A seconda della novità del farmaco, possono essere applicati percorsi normativi come le NDA o la 505(b)(2).Per ottenere l'approvazione e garantire la sicurezza del paziente, è necessario prendere in considerazione anche precauzioni come i rischi di irritazione cutanea e le restrizioni d'uso (ad esempio, evitare l'esposizione al calore).

Punti chiave spiegati:
-
Percorsi normativi e conformità
- Gli sponsor devono scegliere tra una New Drug Application (NDA) per i nuovi farmaci e un percorso 505(b)(2) per le riformulazioni dei farmaci approvati.
- Conformità con cerotti transdermici La normativa richiede la dimostrazione della sicurezza, dell'efficacia e della qualità attraverso studi clinici, compresi studi di biodisponibilità.
- Sono obbligatorie un'etichettatura e una documentazione chiare, che indichino in dettaglio le istruzioni d'uso, le controindicazioni (per esempio, la psicosi legata alla demenza) e le precauzioni (per esempio, evitare l'esposizione all'alcol o al calore).
-
Chimica, produzione e controlli (CMC)
- L'esperienza nella formulazione è fondamentale per garantire la stabilità del farmaco, l'assorbimento e la velocità di rilascio costante.
- La scalabilità e la garanzia di qualità durante la produzione commerciale devono essere in linea con gli standard GMP.
- I test analitici convalidano le prestazioni del patch, compresi i profili di rilascio del farmaco e le proprietà di adesione.
-
Considerazioni sulla progettazione del farmaco e del patch
- Le proprietà molecolari (ad esempio, dimensioni ridotte, lipofilia) influenzano i tassi di assorbimento e devono essere ottimizzate durante lo sviluppo.
- I fattori ambientali (temperatura, umidità) e le variabili specifiche del paziente (condizioni della pelle, età) influenzano l'efficacia e richiedono test in condizioni realistiche.
- I cerotti devono bilanciare la somministrazione del farmaco con il comfort, riducendo al minimo l'irritazione della pelle o le reazioni allergiche.
-
Precauzioni per la sicurezza e l'uso
- L'etichettatura deve mettere in guardia da rischi quali l'irritazione cutanea, l'esposizione al calore (ad es., cuscinetti riscaldanti) e le interazioni con sostanze come l'alcol.
- Popolazioni specifiche (soggetti in gravidanza/allattamento, soggetti affetti da psicosi) possono richiedere controindicazioni.
- Le linee guida per l'uso (ad esempio, sostituzione ogni 72 ore, protocolli di tapering) devono essere comunicate chiaramente ai pazienti.
-
Requisiti clinici e post-marketing
- Gli studi di biodisponibilità confrontano la somministrazione transdermica con altre vie (ad esempio, quella orale) per stabilire l'equivalenza o la superiorità.
- La sorveglianza post-market monitora la sicurezza nel mondo reale, assicurando la compliance a lungo termine e affrontando gli effetti avversi imprevisti.
Affrontando queste aree, gli sviluppatori possono superare gli ostacoli normativi e fornire terapie transdermiche efficaci e adatte ai pazienti.Avete pensato a come gli adesivi per cerotti potrebbero evolvere per ridurre l'irritazione della pelle senza compromettere la somministrazione dei farmaci?
Tabella riassuntiva:
| Considerazioni normative chiave | Dettagli |
|---|---|
| Percorsi normativi | NDA per i nuovi farmaci; 505(b)(2) per le riformulazioni.Richiede studi clinici e di biodisponibilità. |
| Conformità CMC e GMP | Stabilità della formulazione, produzione scalabile e test analitici (rilascio del farmaco, adesione). |
| Fattori di progettazione dei patch | Ottimizzare le proprietà del farmaco (dimensioni, lipofilia), le variabili ambientali/paziente e i rischi di irritazione cutanea. |
| Sicurezza ed etichettatura | Avvisare dell'esposizione al calore, delle interazioni con l'alcol e delle controindicazioni per le popolazioni ad alto rischio. |
| Sorveglianza post-marketing | Monitorare la sicurezza nel mondo reale e l'efficacia a lungo termine dopo l'approvazione. |
Avete bisogno di una guida esperta per lo sviluppo di cerotti transdermici? Collaborate con Enokon Enokon è un affidabile produttore di cerotti transdermici e cerotti antidolorifici per marchi e distributori del settore sanitario.La nostra esperienza tecnica garantisce la perfetta conformità ai requisiti CMC, GMP e ai test clinici, mentre le nostre soluzioni personalizzate di R&S ottimizzano la somministrazione dei farmaci e la sicurezza dei pazienti. Contattateci oggi stesso per discutere del vostro progetto!
Guida Visiva
Prodotti correlati
- Cerotti antidolorifici al calore dell'infrarosso lontano Cerotti transdermici
- Cerotti riscaldanti antidolorifici per i crampi mestruali
- Toppa protettiva per gli occhi a base di erbe Toppa per gli occhi
- Cerotto antidolorifico in gel al mentolo
- Cerotto antidolorifico di medicina al mentolo Icy Hot
Domande frequenti
- Come si colloca il nuovo cerotto all'ibuprofene rispetto ai cerotti antidolorifici esistenti in commercio?Scoprite l'innovazione nel trattamento mirato del dolore
- Perché il materiale Teflon è preferito per gli stampi utilizzati nella preparazione di film per cerotti transdermici? Garantire la precisione del dosaggio.
- Perché il film PVDF idrofilo ad alta porosità viene utilizzato nello strato del serbatoio? Ottimizza il Carico del Farmaco e il Rilascio Uniforme
- Quali condizioni legate alla menopausa può trattare il sistema transdermico di estradiolo?Sollievo per le vampate di calore e l'atrofia vaginale
- Quali sono le potenziali applicazioni future della nuova tecnologia dei cerotti?Esplorare le soluzioni transdermiche di nuova generazione
- Come si applica il metilfenidato transdermico?Una guida passo-passo per un uso sicuro ed efficace
- Quali sono le funzioni chiave delle apparecchiature di essiccazione a spruzzo nei sistemi transdermici? Ottimizzare le nanoparticelle per la somministrazione di farmaci
- Come devono essere conservati il diclofenac gel e i cerotti?Linee guida essenziali per la sicurezza e l'efficacia

















