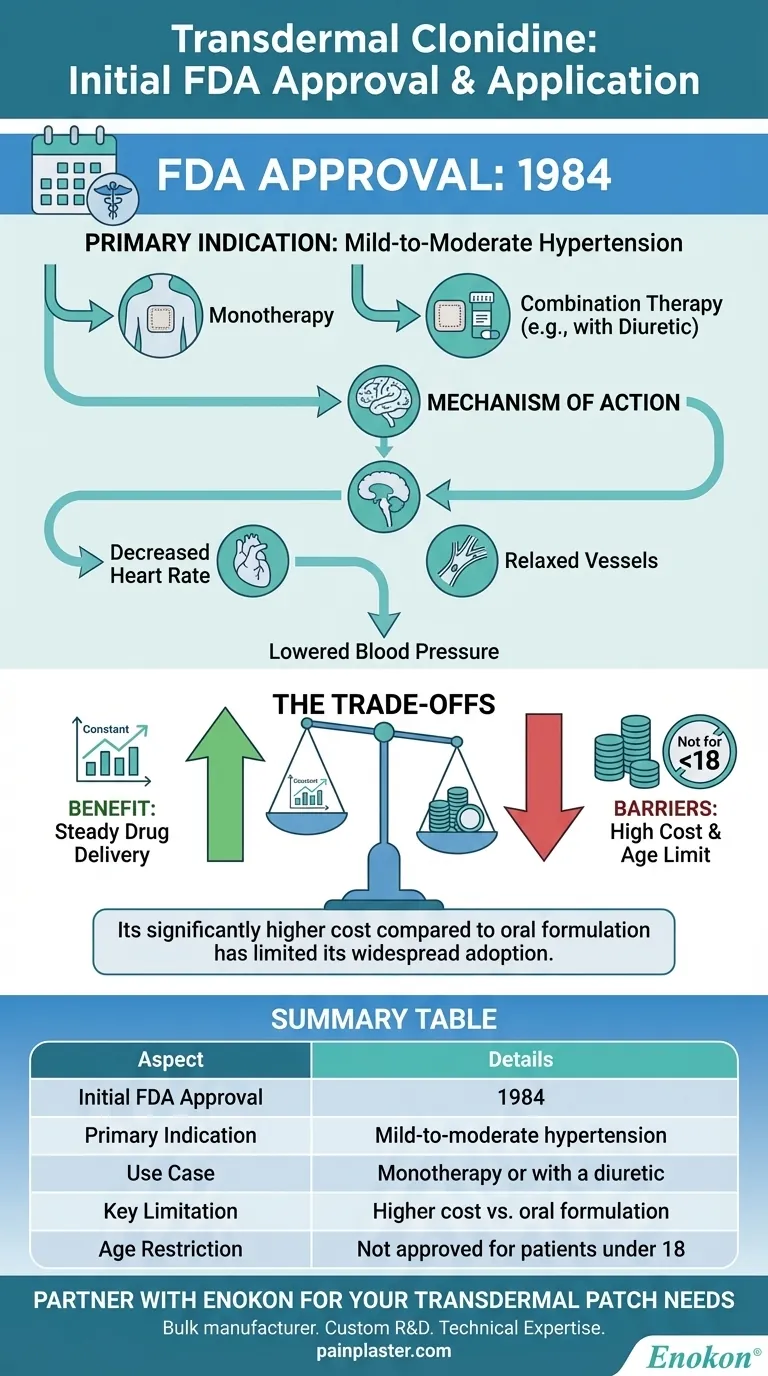
La clonidina transdermica è stata inizialmente approvata dalla Food and Drug Administration (FDA) statunitense nel 1984 per il trattamento dell'ipertensione da lieve a moderata, sia come terapia a sé stante che in combinazione con un diuretico.Questa approvazione ha segnato l'introduzione di un nuovo metodo di somministrazione della clonidina, sfruttando la sua capacità di abbassare la pressione sanguigna attraverso meccanismi alfa-agonisti centrali.Il cerotto transdermico offriva vantaggi quali il rilascio prolungato del farmaco e una migliore compliance del paziente, rappresentando all'epoca un progresso significativo nella gestione dell'ipertensione.
Punti chiave spiegati:
-
Approvazione iniziale della FDA (1984)
- Il cerotto transdermico alla clonidina è stato approvato dalla FDA nel 1984, specificamente per la gestione dell'ipertensione da lieve a moderata.
- Questa approvazione ne ha convalidato l'efficacia come monoterapia o in aggiunta ai diuretici, rispondendo a un bisogno critico di opzioni antipertensive a lunga durata d'azione.
-
Indicazione primaria:Ipertensione
-
Il cerotto è stato progettato per fornire una somministrazione continua di clonidina, riducendo la pressione arteriosa:
- Riducendo la frequenza cardiaca.
- Rilassa i vasi sanguigni per migliorare la circolazione.
- La sua classificazione come agente ipotensivo alfa-agonista ad azione centrale sottolinea il suo meccanismo d'azione nel tronco encefalico per modulare il flusso simpatico.
-
Il cerotto è stato progettato per fornire una somministrazione continua di clonidina, riducendo la pressione arteriosa:
-
Vantaggi della somministrazione transdermica
- A differenza delle formulazioni orali, il cerotto garantisce livelli di farmaco costanti, riducendo al minimo le fluttuazioni tra picco e fondo.
- La riduzione della frequenza di dosaggio (ad esempio, applicazione settimanale) ha migliorato l'aderenza, in particolare per condizioni croniche come l'ipertensione.
-
Limitazioni di età
- In particolare, la forma transdermica non è stata approvata per i pazienti di età inferiore ai 18 anni, a causa dei limitati dati sulla sicurezza nelle popolazioni pediatriche dell'epoca.
-
Contesto storico
- L'approvazione del 1984 ha rappresentato un'innovazione nella somministrazione di farmaci, allineandosi alla più ampia tendenza verso terapie non orali per le malattie cardiovascolari.
- Il cerotto integrava la clonidina orale esistente, offrendo un'alternativa ai pazienti con problemi di tollerabilità gastrointestinale.
Il cerotto transdermico alla clonidina rimane una testimonianza di come i sistemi di somministrazione mirata dei farmaci possano trasformare la gestione delle malattie croniche, ottimizzando silenziosamente la terapia attraverso la scienza della pelle.
Tabella riassuntiva:
| Aspetto chiave | Dettagli |
|---|---|
| Anno di approvazione FDA | 1984 |
| Indicazione primaria | Ipertensione da lieve a moderata (in monoterapia o con diuretici) |
| Meccanismo d'azione | Alfa-agonista ad azione centrale, riduce l'efflusso di simpatico |
| Vantaggi principali | Rilascio costante del farmaco, maggiore compliance, dosaggio settimanale |
| Limitazioni di età | Non approvato per i pazienti di età inferiore ai 18 anni |
Avete bisogno di soluzioni transdermiche affidabili per l'ipertensione o il dolore cronico?
Enokon è specializzata in cerotti transdermici di alta qualità, combinando decenni di esperienza con una ricerca e sviluppo personalizzabile per marchi farmaceutici e distributori.
Contattateci oggi stesso
per discutere del vostro progetto: innoviamo insieme!
Guida Visiva
Prodotti correlati
- Cerotti antidolorifici al calore dell'infrarosso lontano Cerotti transdermici
- Cerotti riscaldanti antidolorifici per i crampi mestruali
- Cerotti per il sollievo dal calore profondo a infrarossi lontani Cerotti medicati per il sollievo dal dolore
- Toppa protettiva per gli occhi a base di erbe Toppa per gli occhi
- Cerotto antidolorifico in gel al mentolo
Domande frequenti
- Quali sono gli effetti collaterali comuni dell'uso del cerotto termico medicato?Comprendere i rischi e l'uso sicuro
- Come funziona la capsaicina nel cerotto termico medicato?La scienza alla base del dolore
- Per quali tipi di dolore può essere utilizzato il Deep Heat Pain Relief Back Patch?Alleviare il disagio muscoloscheletrico in modo naturale
- Come funziona il cerotto per la schiena Deep Heat Pain Relief?Sollievo dal dolore senza farmaci con il calore terapeutico
- In che modo i cerotti antidolorifici Deep Heat forniscono sollievo dal dolore?Terapia termica mirata per un comfort duraturo
















