Il cerotto Lidoderm, un cerotto analgesico topico, è stato approvato dalla FDA nel 1999.Questa approvazione ha segnato la sua introduzione come dispositivo medico per il sollievo dal dolore, sfruttando la lidocaina per fornire un trattamento localizzato.Il design e l'efficacia del cerotto hanno soddisfatto gli standard normativi richiesti per tali prodotti, assicurandone la disponibilità per i pazienti che necessitano di soluzioni non invasive per la gestione del dolore.
Punti chiave spiegati:
-
Anno di approvazione della FDA:
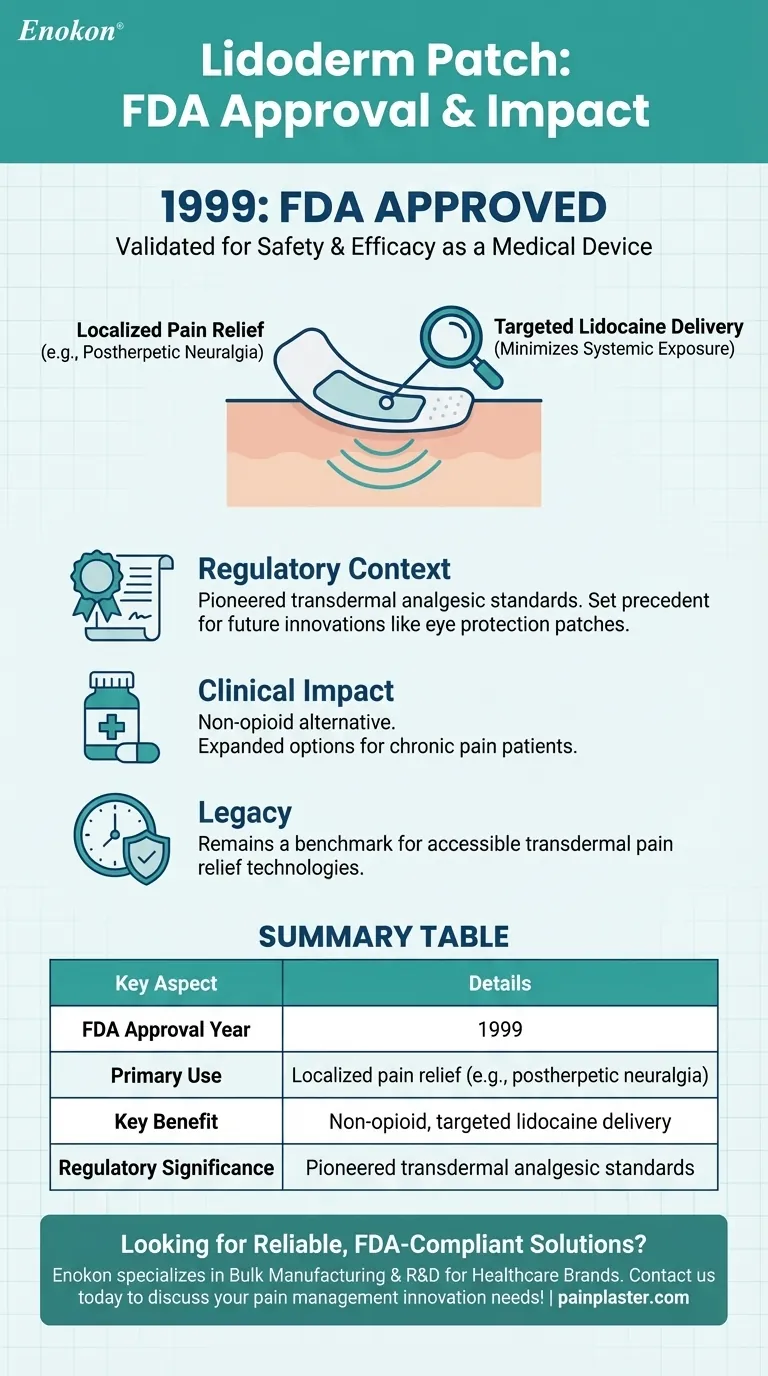
- Il cerotto Lidoderm è stato approvato dalla Food and Drug Administration (FDA) degli Stati Uniti nel 1999 .Questo traguardo ha convalidato la sicurezza e l'efficacia del cerotto per l'uso clinico.
- Il processo di approvazione ha comportato test rigorosi per garantire che il cerotto soddisfacesse gli standard per la somministrazione efficace di lidocaina senza effetti collaterali sistemici.
-
Scopo e design:
- Il cerotto è stato progettato per fornire un sollievo dal dolore localizzato, in particolare per condizioni come la nevralgia posterpetica (dolore legato all'herpes zoster).
- Il suo supporto adesivo consente una somministrazione mirata di lidocaina, riducendo al minimo l'esposizione ad altre aree del corpo.
-
Contesto normativo:
- L'approvazione della FDA nel 1999 ha collocato il cerotto Lidoderm tra le prime innovazioni nel campo degli analgesici topici.
- Ha creato un precedente per prodotti simili, come il cerotto di protezione per gli occhi , che in seguito è stato utilizzato per diverse applicazioni terapeutiche.
-
Impatto clinico:
- Il cerotto offre un'alternativa non oppiacea per la gestione del dolore, in linea con la crescente enfasi sulla riduzione dell'uso di farmaci sistemici.
- La sua approvazione ha ampliato le opzioni per i pazienti con dolore cronico, in particolare quelli sensibili ai farmaci orali.
Il cerotto Lidoderm rimane un punto di riferimento per il trattamento del dolore per via transdermica, a testimonianza del ruolo dell'FDA nel promuovere tecnologie sanitarie accessibili.
Tabella riassuntiva:
| Aspetto chiave | Dettagli |
|---|---|
| Anno di approvazione FDA | 1999 |
| Uso primario | Sollievo dal dolore localizzato (ad esempio, nevralgia post-erpetica) |
| Vantaggi principali | Somministrazione mirata di lidocaina non oppioide con minima esposizione sistemica |
| Importanza normativa | Pionieri degli standard analgesici transdermici |
Cercate soluzioni antidolorifiche transdermiche affidabili e conformi alla FDA? Enokon è specializzata nella produzione all'ingrosso di cerotti analgesici di alta qualità e nella R&S personalizzata per i marchi del settore sanitario. Contattateci oggi stesso per discutere le vostre esigenze e sfruttare la nostra esperienza nell'innovazione della gestione del dolore!
Guida Visiva
Prodotti correlati
- Toppa protettiva per gli occhi a base di erbe Toppa per gli occhi
- Cerotto antidolorifico in idrogel di lidocaina per alleviare il dolore
- Cerotto per gli occhi Hydra Gel Health Care
- Cerotto antidolorifico di medicina al mentolo Icy Hot
- Cerotto per la tosse e il dolore da asma per adulti e bambini
Domande frequenti
- Quali sono i fattori da considerare quando si acquistano le bende per gli occhi?Guida essenziale per un uso sicuro ed efficace
- Quando è necessario consultare un medico per l'uso di questo cerotto?Linee guida fondamentali per la sicurezza
- I cerotti per gli occhi vanno applicati prima o dopo la crema idratante?Ottimizzare la routine di cura della pelle
- In che modo i cerotti per gli occhi migliorano l'efficacia delle creme per gli occhi?Potenziare la routine di cura degli occhi
- Quali sono i principali benefici dell'uso dei cerotti per gli occhi in una routine di cura della pelle?Rivitalizzano la zona sotto gli occhi
















